检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
叶酸(维生素B9)作为一碳转移反应的辅酶,参与嘌呤和胸苷酸合成、丝氨酸和蛋氨酸代谢以及核酸和蛋白质的甲基化修饰等生理进程。叶酸代谢异常会引起严重的发育缺陷和多种疾病,包括癌症和神经系统疾病等。哺乳动物缺乏自主合成叶酸的能力,因此,必须依赖特定的转运或受体蛋白从胞外摄取叶酸。还原性叶酸转运蛋白SLC19A1(或RFC)在多种细胞类型中广泛表达,是人体大部分组织器官摄取叶酸的主要途径。此外,抗叶酸药物,如甲氨蝶玲(methotrexate)等,被广泛应用于多种肿瘤和自身免疫性疾病的治疗。作为叶酸类似物,这些药物也主要依赖SLC19A1蛋白被转运进入细胞内从而发挥功能。
金沙集团wwW3354CC和生命科学联合中心张哲课题组于2022年12月28日在Cell Discovery杂志发表了题为“Molecular mechanism of substrate recognition by folate transporter SLC19A1”的研究论文。本工作报道了人源SLC19A1蛋白分别与两种底物5-甲基四氢叶酸(5-MTHF)和硫胺素焦磷酸(TPP)结合的冷冻电镜结构。结合生化和细胞实验,作者阐明了SLC19A1蛋白底物识别的分子机制,并证实了TPP是SLC19A1蛋白转运叶酸的反向偶联底物。同时,本研究还为抗叶酸药物的优化和改造提供了重要的理论基础。
人源SLC19A1蛋白的分子量仅65kDa,主要由12条跨膜螺旋(TM)组成,这为采用冷冻电镜技术直接解析其高分辨率结构带来了巨大的挑战。为了解决这一难题,作者巧妙组装了BRIL-SLC19A1/Fab/Nb三元复合物,并成功解析了该复合物分辨率为3.6 Å的冷冻电镜结构。该结构中,SLC19A1蛋白采用经典的MFS超家族折叠模式,并呈现inward-facing构象。利用同样的策略,作者进一步解析了SLC19A1蛋白与最适还原性叶酸底物5-MTHF的复合物结构。通过对5-MTHF结合位点的突变分析,作者鉴定出SLC19A1蛋白中的Glu123、Arg133、Tyr281和Arg373四个氨基酸残基对于5-MTHF 的识别和转运至关重要。另外,通过进一步的结构分析和功能验证,作者还揭示了SLC19亚家族中另外两个同源性极高的家族成员SLC19A2和SLC19A3不识别叶酸的分子机制。
SLC19A1作为一个反向转运蛋白,转运叶酸需要与另外一个底物的反向转运相偶联,然而,该底物的具体身份领域内还存在争议。根据此前的报道,作者对多种潜在的有机磷酸盐底物进行了测试,包括ATP和NAD+等。竞争性转运抑制实验、热稳定性实验以及MST实验结果共同表明,TPP最可能是在生理条件下被SLC19A1蛋白用于偶联叶酸转运的底物。于是,作者进一步解析了SLC19A1蛋白与TPP的复合物结构,发现TPP与5-MTHF的结合位点和方式几乎一致。
根据以上实验结果,作者最终提出了SLC19A1蛋白利用alternating access机制反向转运5-MTHF和TPP的模型(图1)。细胞内高浓度的TPP结合SLC19A1蛋白后诱导其从inward-facing构象转变为outward-facing构象,在该构象下TPP被释放到细胞外,而5-MTHF则结合到相同的位点,并诱导相反的构象变化;当SLC19A1蛋白重新变回inward-facing构象后,5-MTHF则被释放,TPP重新结合,由此完成一个转运循环。在该过程中,SLC19A1蛋白利用顺电化学梯度向胞外转运TPP所提供的能量实现对5-MTHF向胞内的逆电化学梯度转运。
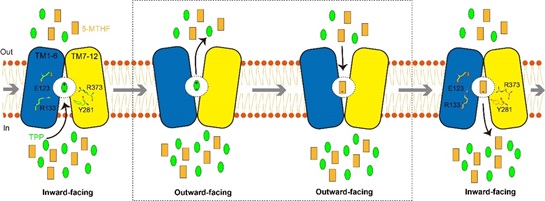
图1. SLC19A1蛋白反向转运5-MTHF和TPP的模型。
金沙集团wwW3354CC张哲研究员为本文通讯作者,北京大学前沿交叉学科研究院2019级PTN项目博士生党瑜为本文第一作者。另外,北京大学前沿交叉学科研究院2020级博士生周栋、课题组前技术员杜晓娟、金沙集团wwW3354CC杨竞教授、美国圣裘德儿童研究医院Hongtu Zhao博士和Chia-Hsueh Lee研究员、金沙集团wwW3354CC2019级本科生王祎洁以及金沙集团wwW3354CC冷冻电镜平台秦昌东博士和郭振玺博士对本文做出重要贡献。本研究得到国家重点研发计划重点专项、国家自然科学基金面上项目、生命科学联合中心、膜生物学国家重点实验室、金沙集团wwW3354CC启东产业创新基金以及李革-赵宁生命科学青年研究基金的资助;并依托北京大学冷冻电镜平台和金沙集团wwW3354CC公共仪器中心凤凰工程蛋白质平台的技术支持。