检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
疟疾仍然是世界范围内的重要公共卫生问题。据世界卫生组织统计,2020年全球共计约有2.41亿人感染疟疾,造成约62.7万人死亡 [1]。疟疾是一种由疟原虫感染引起的寄生虫病,其中恶性疟原虫致死率最高。恶性疟原虫以裂殖子形式感染红细胞并在其中繁殖,最终导致红细胞的裂解,从而引起发热和溶血性贫血等临床症状。一些被感染的红细胞会黏附在胎盘或者大脑的内皮细胞上,引起胎型疟和脑型疟等危重症状。
抗体是人体免疫系统的核心组成部分,对抵御包括恶性疟原虫在内的多种病原体具有重要保护作用。其中,IgM型抗体是人体体液免疫反应的第一道防线,主要以五聚体的形式存在,包含十个抗原结合位点,能够高效地结合并中和病原体 [2-3]。此外,IgM还能有效的激活经典补体通路,在抵御疟疾的过程中发挥重要作用 [4]。北京大学肖俊宇研究组聚焦对IgM分子机制的研究,在之前工作中阐明了IgM五聚体组装和黏膜转运的机制、以及IgM被特异性受体识别的机制 [5, 6]。
在与人类长期的“军备竞赛”中,恶性疟原虫演化出了拮抗IgM的机制。例如,恶性疟原虫会表达一类被称为PfEMP1的毒力蛋白,并将其分泌至红细胞表面。这些蛋白分子量为250~350 kDa,有一个很大的胞外区,包含多个达菲样结构域(Duffy-binding-like domain, DBL),可以结合很多人体分子 [7]。例如,PfEMP1家族的VAR2CSA蛋白能够结合胎盘表面的硫酸软骨素,从而将感染的红细胞滞留于胎盘中的毛细血管,引起胎型疟 [8]。PfEMP1-TM284VAR1则能够显著引起红细胞的花簇状聚集(Rosetting),导致脑型疟 [9]。定位在恶性疟原虫裂殖子表面的DBLMSP蛋白家族成员也能够招募IgM并利用其逃逸人体的免疫攻击 [10]。对这些恶性疟原虫蛋白与IgM的互作机制之前还没有得到充分理解。
2023年5月8 日,北京大学肖俊宇课题组在Nature Communications期刊发表了题为“Plasmodium falciparum has evolved multiple mechanisms to hijack human immunoglobulin M”的研究成果,发现恶性疟原虫蛋白演化出了多种不同的IgM结合模式,为进一步理解恶性疟原虫的免疫逃逸机制提供了重要基础。
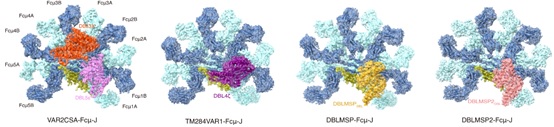
图1. 四种恶性疟原虫蛋白与IgM核心区形成复合体的冷冻电镜结构。
该研究体外纯化了VAR2CSA和TM284VAR1的胞外域,以及DBLMSP和DBLMSP2的DBL结构域,并将它们分别与IgM五聚体的核心区域组装成复合体,然后利用冷冻电镜技术解析了这些复合体的结构(图1)。结果显示,虽然这些恶性疟原虫蛋白均通过其DBL结构域与IgM的中心区结合,但它们与IgM的相互作用存在多种不同模式。VAR2CSA通过DBL3X和DBL5ε两个结构域同时与三个IgM-Fc(Fcμ)单元结合。DBL3X通过子结构域1(SD1)结合Fcμ2B链和Fcμ3B链,而DBL5ε则通过SD1与Fcμ1B和Fcμ2B相互作用。另一个PfEMP1蛋白TM284VAR1虽然也含有多个DBL结构域,但只利用其DBL4ζ结构域与IgM结合。与DBL3X和DBL5ε的结合模式不同,DBL4ζ通过子结构域SD1和SD2介导与Fcμ1B、Fcμ2A和Fcμ2B的相互作用。DBLMSP家族的两个蛋白DBLMSP和DBLMSP2则通过其DBL结构域中的三个子结构域SD1、SD2和SD3与Fcμ1A、Fcμ1B和Fcμ2B链结合,展示了另外两种不同的结合模式。
那么,恶性疟原虫是如何利用IgM来逃逸人体的免疫系统呢?根据结构研究和生化结果分析,可以将其免疫逃逸机制归纳为以下三个方面:首先,恶性疟原虫蛋白与IgM的结合区域是IgM受体分子(pIgR、FcμR等)相互作用的主要热点区域,因此恶性疟原虫蛋白与IgM的结合会干扰IgM与受体的结合,从而抑制相关的免疫信号通路。其次,IgM会遮盖许多已知的抗原表位,从而使恶性疟原虫蛋白逃逸人体IgG中和抗体的攻击。此外,由于空间位阻效应,与恶性疟原虫蛋白结合的IgM无法再与C1复合体结合、或者无法与抗原发生有效结合,从而阻碍IgM对经典补体途径的激活(图2)。
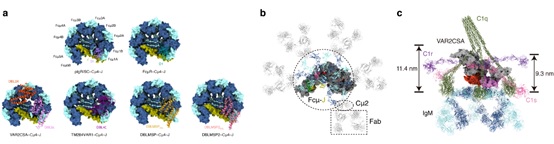
图2. 恶性疟原虫利用IgM介导免疫逃逸。
总之,这一工作厘清了恶性疟原虫蛋白与IgM相互作用的复杂分子机制。本应作为人体免疫系统攻击疟原虫有效武器的IgM,反而被恶性疟原虫的多个分子以不同方式“劫持”,充当了保护疟原虫的“盾牌”(图3)。

图3. IgM被恶性疟原虫蛋白劫持充当“盾牌”。
蛋白质与植物基因研究国家重点实验室、金沙集团wwW3354CC、北大清华生命科学联合中心肖俊宇研究员为该论文的通讯作者。北京大学博士后纪成功和金沙集团wwW3354CC19级博士生沈皓为该论文的共同第一作者。本研究得到了昌平实验室、金沙集团wwW3354CC启东产业创新基金和北京大学博雅博士后项目的支持。
原文链接:https://www.nature.com/articles/s41467-023-38320-z
参考文献:
1. World malaria report 2021. Geneva: World Health Organization (2021). Licence: CC BY-NC-SA 3.0 IGO.
2. Heyman, B. & Shulman, M. J. in Encyclopedia of Immunobiology (ed Michael J. H. Ratcliffe) 1-14 (Academic Press, 2016).
3. Keyt, B. A., Baliga, R., Sinclair, A. M., Carroll, S. F. & Peterson, M. S. Structure, Function, and Therapeutic Use of IgM Antibodies. Antibodies (Basel) 9, doi:10.3390/antib9040053 (2020).
4. Boyle, M. J. et al. IgM in human immunity to Plasmodium falciparum malaria. Sci Adv 5, eaax4489, doi:10.1126/sciadv.aax4489 (2019).
5. Li, Y. et al. Structural insights into immunoglobulin M. Science 367, 1014-1017, doi:10.1126/science.aaz5425 (2020).
6. Li, Y. et al. Immunoglobulin M perception by FcmuR. Nature 615, 907-912, doi:10.1038/s41586-023-05835-w (2023).
7. Wahlgren, M., Goel, S. & Akhouri, R. R. Variant surface antigens of Plasmodium falciparum and their roles in severe malaria. Nat Rev Microbiol 15, 479-491, doi:10.1038/nrmicro.2017.47 (2017).
8. Fried, M. & Duffy, P. E. Adherence of Plasmodium falciparum to chondroitin sulfate A in the human placenta. Science 272, 1502-1504, doi:10.1126/science.272.5267.1502 (1996).
9. Ghumra, A. et al. Identification of residues in the Cmu4 domain of polymeric IgM essential for interaction with Plasmodium falciparum erythrocyte membrane protein 1 (PfEMP1). J Immunol 181, 1988-2000,doi:10.4049/jimmunol.181.3.1988 (2008).
10. Crosnier, C. et al. Binding of Plasmodium falciparum Merozoite Surface Proteins DBLMSP and DBLMSP2 to Human Immunoglobulin M Is Conserved among Broadly Diverged Sequence Variants. J Biol Chem 291, 14285-14299, doi:10.1074/jbc.M116.722074 (2016).