检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
Nucleic Acids Research期刊于2023年6月29日在线发表了北京大学生科院及蛋白质与植物基因研究国家重点实验室郑晓峰教授研究组的题为“ATM–ESCO2–SMC3 axis promotes 53BP1 recruitment in response to DNA damage and safeguards genome integrity by stabilizing cohesin complex”的研究文章。该研究发现乙酰转移酶ESCO2通过稳定DNA双链断裂损伤位点附近的黏连蛋白复合物和促进53BP1 foci形成参与DNA损伤应答过程,维持基因组稳定性,揭示了ESCO2在调控结直肠癌耐药中的分子机制。
细胞受到内、外源刺激常引起DNA损伤,其中DNA双链断裂( DSBs)是最严重的损伤类型之一。为了维持基因组稳定性,哺乳动物细胞主要利用非同源末端连接(NHEJ)和同源重组(HR)对DSB损伤进行修复。在癌细胞中DSB损伤修复能力的增强会导致DNA复制速率加快和细胞凋亡逃逸。因此,鉴定在DSB损伤修复过程中发挥重要功能的蛋白质并阐明其在肿瘤发生发展中的作用,有助于为克服放化疗耐药性和寻找癌症治疗新靶点提供理论基础。已有的研究发现乙酰转移酶ESCO2通过乙酰化修饰黏连蛋白复合物(Cohesin)的SMC3亚基使该复合物稳定结合在染色质上,ESCO2单基因功能缺失型突变导致的罗伯茨综合征病人的成纤维细胞呈现对DNA损伤更加敏感的现象,提示ESCO2可能参与DSB损伤修复过程。
该研究首先通过激光微辐射实验、免疫荧光实验和中性彗星实验发现ESCO2能够促进DSB损伤修复过程并维持基因组稳定性。接着,对TCGA数据库分析发现ESCO2在结直肠癌病人样本中异常高表达。在结直肠癌细胞中敲低ESCO2会导致癌细胞对诱导DNA损伤的药物奥沙利铂和博来霉素更加敏感。对ESCO2作用机制的进一步研究发现,ESCO2能够响应DNA损伤刺激被ATM磷酸化修饰,磷酸化的ESCO2被MDC1识别并招募至损伤位点处。损伤位点附近的ESCO2通过乙酰化修饰SMC3 K105/106稳定黏连蛋白复合物从而促进53BP1 foci形成。ESCO2缺失会导致53BP1 foci数量减少和NHEJ修复效率下降。此外,裸鼠成瘤实验表明,ESCO2的缺失会导致结直肠癌对奥沙利铂更加敏感,并且ESCO2调控肿瘤化疗耐药依赖于其在DSB损伤修复中的功能。
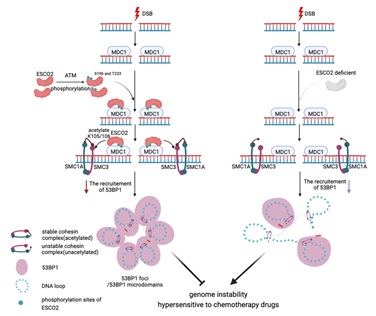
ESCO2应答DNA损伤调控黏连蛋白复合物和53BP1 foci形成的模式图
该研究揭示了ESCO2参与DSB损伤修复过程的分子机制,阐明了DSB断裂位点附近黏连蛋白复合物在NHEJ修复途径中发挥促进作用。证明了ATM-ESCO2-SMC3轴调控53BP1 foci形成的功能,为深入了解染色质结构与DNA损伤修复相互调节关系以及靶向DNA损伤修复途径的肿瘤治疗提供了新的信息。
北京大学郑晓峰教授课题组博士研究生付剑锋为本文第一作者,郑晓峰教授为文章通讯作者。北京大学郑晓峰课题组博士研究生周思汝,徐慧琳,廖礼铭和北京大学杜鹏教授课题组申辉博士也在该研究中做出重要贡献。该研究得到了国家自然科学基金重点项目、蛋白质与植物基因研究国家重点实验室、金沙集团wwW3354CC、金沙集团wwW3354CC仪器平台以及凤凰中心的大力支持。
原文链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkad533/7209337