检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
异基因造血干细胞移植(allo-HSCT)是目前治疗血液系统恶性肿瘤的有效手段。但移植后合并症移植物抗宿主疾病(Graft-versus-host disease, GVHD)是造成移植后患者死亡的主要原因之一,严重的影响了患者的生存及生活质量。GVHD可分为急性GVHD(aGVHD)和慢性GVHD(cGVHD),aGVHD在造血干细胞移植患者中的发生率约为25%-55%,而cGVHD在患者中的发生率约为40%。无论是aGVHD还是cGVHD患者,对于一线激素治疗无效的患者,目前均缺乏有效的二线治疗药物。而激素治疗无效的aGVHD患者长期生存率较低,仅为5%-30%。因此,寻找aGVHD有效预防及干预靶点是亟待解决的科学和临床问题。
G-CSF(Granulocyte colony-stimulating factor)是粒细胞刺激因子,可以刺激骨髓中髓系祖细胞增殖并向成熟粒细胞分化发育。对于健康供者给予G-CSF预处理,不仅可以将骨髓中CD34+造血干细胞动员至外周血,同时G-CSF还可以通过调控T细胞以及APCs(抗原提呈细胞)的活性和功能而进一步调控免疫系统。在临床研究及小鼠GVHD模型中均表明,G-CSF可通过抑制T细胞活化,诱导产生T细胞免疫耐受从而降低aGVHD的发生。然而,G-CSF诱导T细胞免疫耐受的分子机制尚未有明确研究。
2022年5月18日,北京大学黄晓军、李程、常英军合作,在《Advanced Science》期刊发表了 “Multiomics Analysis Identifies SOCS1 as Restraining T Cell Activation and Preventing Graft-Versus-Host Disease”的研究论文。在本项研究中,研究人员利用多组学测序手段RNA-seq,ATAC-seq,Hi-C等技术,分析了G-CSF动员前、后健康供者骨髓来源的CD3+CD4+和CD3+CD8+ T细胞的转录组、染色质开放性及三维基因组结构变化(图1A)。多组学分析提示,G-CSF动员后的T细胞中正向调控T细胞相关活化基因的表达水平下调,负向调控T细胞增殖及活化相关信号通路表达上调(图1B)。ATAC-seq分析也表明,T细胞活化相关基因所在染色质区域在G-CSF动员后的T细胞中染色质开放性下降(图1C)。

图1 G-CSF动员前后T细胞转录组及染色质可及性变化
通过整合RNA-seq,ATAC-seq及Hi-C的多组学数据分析,研究人员发现SOCS1是G-CSF动员后表达水平上调最为显著的基因,而转录因子STAT3可能是直接调控SOCS1表达的上游因子(图2A)。进一步整合分析原代T细胞中增强子信号(H3K27ac)以及STAT3的染色质结合(CUT&Tag)数据发现,G-CSF可能通过重构SOCS1基因编码区的染色质三维结构上调SOCS1表达水平。在G-CSF动员后的T细胞中SOCS1的基因编码区附近,STAT3的结合重构染色质环,促使SOCS1启动子区域与上游的增强子区域互作加强,而由CTCF介导的SOCS1启动子区域与下游的异染色质区域互作水平降低,从而上调了SOSC1的表达水平(图2B)。
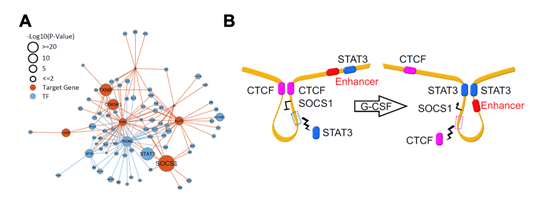
图2 G-CSF通过STAT3介导的染色质环重构上调T细胞SOCS1表达水平
进一步,为了验证SOCS1在T细胞活化中的调控作用,研究人员首先利用慢病毒在体外人原代T细胞中过表达了SOCS1基因,发现T细胞增殖能力显著降低,同时T细胞耗竭相关分子TIGIT表达显著上调。接着构建了T细胞特异性敲除Socs1的转基因小鼠,从体内水平探索SOCS1对T细胞的调控作用。T细胞缺失Socs1后增殖能力显著增强,促炎因子IFN-γ分泌水平显著增多。此外,在由供鼠C57BL/6移植受鼠BALB/c建立的 GVHD小鼠模型中,接受Socs1-/- T细胞移植的GVHD受鼠相较于接受野生型T细胞移植的受鼠生存期显著缩短,同时在肝、肺、小肠及大肠等组织有更明显的淋巴细胞侵润导致的组织损伤。研究人员进一步利用G-CSF或PBS预处理的供鼠移植受鼠建立GVHD模型,探索T细胞缺失Socs1后是否影响G-CSF对GVHD受鼠的保护作用。在野生型组,供鼠经过G-CSF处理后相较于PBS处理组显著延长了GVHD小鼠的生存期。而在Socs1-/-组,供鼠经过G-CSF处理后的GVHD受鼠生存期与PBS处理组无显著差异。以上结果提示,T细胞缺失Socs1后G-CSF对GVHD小鼠的保护作用消失,证明G-CSF在体内通过上调T细胞中SOCS1水平从而诱导T细胞进入免疫耐受态,从而降低GVHD损伤。进一步研究发现,SOCS1不仅对CSF3R/JAK2/STAT3信号通路有抑制作用,同时对NLRP3炎症小体信号通路也具有抑制作用。利用SOCS1蛋白功能域拟合肽段体外处理人原代T细胞后,可显著降低T细胞增殖能力,并抑制STAT3的磷酸化水平,这一结果提示,SOCS1由STAT3激活后会负反馈性抑制STAT3的活化。此外,我们还通过小规模临床队列发现,发生GVHD的患者与移植后同期未发生GVHD的患者相比,T细胞中SOCS1的表达水平显著降低。
综上,研究人员通过多组学分析并结合体内及体外功能实验,完善了G-CSF诱导T细胞免疫耐受的分子机制模型:G-CSF通过与T细胞表面受体CSF3R结合,激活STAT3。活化的STAT3进入细胞核,通过重塑SOCS1基因编码区染色质三维结构,上调SOCS1的表达水平。高水平SOCS1不仅可以负反馈抑制CSF3R/STAT3通路,同时还可抑制NLRP3炎症小体信号通路,从而抑制T细胞增殖及炎症因子分泌,诱导T细胞进入免疫耐受态,降低GVHD损伤(图3)。此研究揭示了SOCS1在抑制T细胞活化及降低GVHD中的重要调控作用,为临床进一步干预及预防GVHD提供了新的潜在靶点。
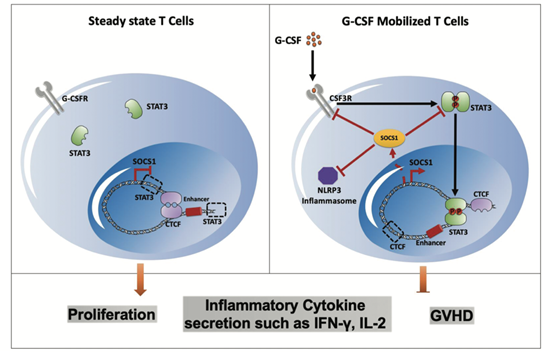
图3 G-CSF诱导T细胞免疫耐受分子调控机制模式图
北京大学人民医院助理研究员郭惠东,北大-清华生命科学联合中心博士生李瑞风(现清华大学博士后)为本文共同第一作者。北京大学血液病研究所所长,国家血液系统疾病临床医学研究中心主任黄晓军教授、金沙集团wwW3354CC李程研究员、北京大学血液病研究所常英军教授为本文的共同通讯作者。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202200978