检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
癌症作为一种细胞异常增殖的疾病,是全球主要的公共卫生问题。癌症的诱因非常复杂,是胞内多种调控通路的突变和微环境共同作用的结果,其中微小RNA(miRNA)是近年来被认为与癌症发生息息相关的重要RNA分子。在哺乳动物中,具有2-nt 3' 末端悬垂的成熟miRNA双链可以被Argonaute(AGO)识别并装载形成RNA诱导的沉默复合体(RISC)进而调控靶基因的表达[1]。在癌症中,全局miRNA剂量减少被认为是癌症发生的诱因之一 [2]。然而,迄今为止对于不同癌症中普遍miRNA缺乏的原因尚未被系统陈述。
细胞周期的过度激活是癌细胞异常增殖的必要条件,因此细胞周期基因是抗癌药物研发的重要靶点。现有细胞周期的药物往往只能针对一种或者几种靶点,因而无法克服基因冗余性而带来的耐药性[3]。有意思的是,许多miRNA都可以直接靶向并抑制细胞周期基因,从而直接控制细胞增殖[4]。因此,能否通过修复肿瘤中有缺陷的miRNA通路从而实现对于肿瘤细胞增殖的抑制,就一直是一个悬而未决的生物学问题。一旦成功,则可开发成为一种肿瘤治疗的新策略。
与miRNA不同,siRNA来源于不同RNA 依赖性 RNA 聚合酶 (RDR) 合成的双链 RNA底物。有趣的是,RDR几乎在所有真核生物中都已被发现,但在进化过程中,其在具有次级免疫系统的脊椎动物中丢失。在植物中,依赖RDR1的siRNA尤其参与抗病毒免疫反应,是植物特有的、最核心的分子免疫反应通路之一[5]。近年来,跨物种生物工程已成功应用于基础研究和转化医学,例如来自细菌的Crispr-Cas。因此,我们尝试从动植物免疫系统的差异出发,在哺乳动物中进行基于植物RDR1的植物基因工程,并研究其相关的转化医学的应用。
2022年5月26日,北京大学杜鹏课题组在Cell杂志在线发表了题为“A plant immune protein enables broad antitumor response by rescuing microRNA deficiency”的研究论文。该研究发现,在不同的人类原发性癌症样本和癌症细胞系中,不能有效结合AGO2复合体的3’末端短1-nt的miRNA异构体广泛积累。异位表达的植物免疫蛋白RDR1通过其单核苷酸加尾修饰这些AGO2游离出的miRNA双链异构体,以重新激活有缺陷的miRNA通路,从而特异性阻断实体瘤和白血病中癌细胞的细胞周期。

在本研究工作中,作者主要有以下发现:
1、RDR1蛋白通过靶向细胞周期广泛抑制癌细胞的增殖
为了在哺乳动物细胞中进行基于植物RDR1的生物工程,作者分别从拟南芥(At)和水稻(Os)中克隆RDR1基因到基于Dox诱导的慢病毒载体上。最终,本研究获得了13个稳定的RDR1诱导细胞系(包括7个实体瘤、3个白血病、3个非癌症细胞系)和2个RDR1恒定表达的胚胎干细胞系。通过Western blot和活细胞成像,作者验证了RDR1在哺乳动物细胞中成功实现了异位表达。
在接下来的研究中,令作者惊讶和意外的是,AtRDR1和OsRDR1能够在体外显著抑制所有10种癌症细胞系的增殖,但对其他5种非癌细胞没有影响(图1)。RDR1还可以显著抑制癌细胞的克隆形成能力。在分子水平上,基于RNA-seq的基因集富集分析(GSEA)表明,AtRDR1和OsRDR1可以干扰所有癌症细胞系中的细胞周期过程,但在非癌对照细胞中没有明显作用(图2)。值得注意的是,短时间(2-3天)诱导RDR1同样可显著抑制癌细胞中的细胞周期过程(图2),表明细胞周期通路可能是RDR1的直接作用靶点。随后,EdU/PI染色分析显示,RDR1在癌细胞中的表达显著降低了S期的细胞比例,反而增加了G0/G1期的细胞比例。因此,作者认为植物免疫蛋白RDR1是一种外源肿瘤抑制因子,它能够特异靶向并干扰癌细胞中的细胞周期过程,但在非癌症细胞中却不起作用。
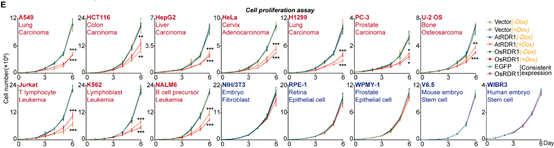
图1 AtRDR1和OsRDR1广谱且特异的抑制癌细胞增殖,但不影响非癌细胞系
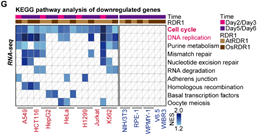
图2 RDR1能够特异靶向并干扰癌细胞的细胞周期,但对非癌细胞不起作用
2、在3’末端短1个碱基的受损的miRNA异构体在多种肿瘤中广泛积累
由于RDR1参与植物中的小RNA通路,作者在RDR1诱导表达前后的癌症和非癌症细胞中进行小RNA 测序。令人惊讶的是,作者发现诱导RDR1后的癌症细胞中miRNA的整体表达明显增加,但在非癌症细胞系中却没有出现这种现象。随后,作者还通过miRNA通路关键组分的敲低和AGO2-CLIP等实验,提出植物RDR1通过提高全局miRNA表达以特异挽救癌细胞中的miRNA缺乏来抑制细胞周期和增殖。
为了进一步研究RDR1特异靶向癌细胞的机制,作者对已公开发表的小RNA测序数据进行系统分析,包括TCGA数据库的9980组癌症病人数据以及GEO数据库的癌症病人、癌症细胞系以及正常组织的数据。结果表明,在很多癌症病人和细胞系的样本中,在3’末端短1-nt的miRNA异构体出现了大量的积累(图3)。这些3’末端短1-nt的miRNA在部分癌症样本中甚至成为不同miRNA异构体中数量最多的群体(图3)。由于AGO蛋白结构的特殊性,2-nt悬垂的结构有利于miRNA双链进入AGO2中形成RISC [6]。作者提出,这种1-nt悬垂的异构体,相比于2-nt悬垂的异构体进入AGO2的效率更低,并通过EMSA和MST实验进行了验证。同时,通过AGO2-IP的小RNA测序,作者进一步分析发现3’末端短1-nt的miRNA异构体在Input组更富集,进一步表现出短1-nt的miRNA异构体进入AGO2的效率更低。综上,作者提出,在癌细胞中,这种短1-nt的异常miRNA双链异构体不能有效地进入到AGO2中,并且不稳定,因此可能与不同肿瘤中的miRNA剂量减少有关。
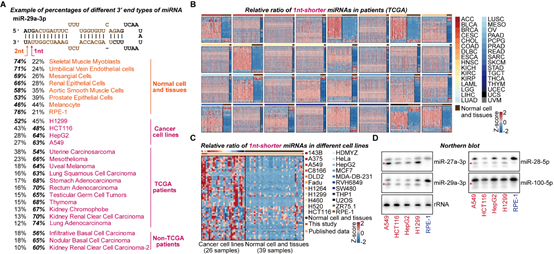
图3 异常的3’末端短1-nt的miRNA异构体在不同的人类肿瘤中广泛积累
3、RDR1通过单核苷酸加尾修复癌症中有问题的miRNA异构体
据报道,植物RDR6同时具有RNA聚合酶和核苷酸转移酶活性[7],而在后续的小RNA测序数据分析中,作者发现具有3’端单核苷酸加尾的成熟miRNA特异富集于RDR1异位表达的癌症细胞中。有趣的是,这种单核苷酸加尾主要出现在3’末端短1-nt的miRNA上,但很少出现在注释的切割末端上。随后作者在大肠杆菌中纯化出重组的rAtRDR1和酶活位点突变的3DA mutant rAtRDR1。通过体外生化实验,作者直接证明了rAtRDR1能够对单链miRNA和具有1-nt或2-nt悬垂的miRNA双链进行3’末端单核苷酸修饰,但不能修饰具有平末端的miRNA双链。
结合以上的发现,作者设想RDR1倾向于识别AGO2中游离出来的具有1-nt悬垂的miRNA双链作为底物,这些异构体尤其在癌症细胞中积累,但在非癌症细胞中不积累,并用单核苷酸加尾修饰这些有问题的miRNA。为了验证这一点,作者首先在表达RDR1的肺癌A549细胞中进行了AGO2敲低实验,随后进行小RNA序列分析。正如预期的那样, AGO2缺失确实进一步加强了RDR1介导的miRNA修饰,在癌细胞中短1-nt的miRNA异构体上单核苷酸加尾的比例大幅提高(图4)。之后,体外将rAGO2与具有1-nt/2-nt悬垂的miRNA双链预孵育后再加入rRDR1进行游离miRNA双链的加尾实验,结果显示与AGO2亲和力较低的1-nt悬垂的miRNA双链在与rAGO2蛋白预孵育后更倾向于被RDR1修饰(图5)。
最后,作者还通过给1-nt悬垂的miRNA双链加尾后的重新结合,1-nt/2-nt外源miR-34c双链的体外转染等实验和分析,共同证明了RDR1拥有核苷酸转移酶活性,能够对AGO2中游离出的短1-nt的miRNA双链异构体进行单核苷酸修饰,以恢复这些异构体对AGO2的装载效率,并最终修复癌症中有缺陷的miRNA通路。

图4 AGO2缺失可显著增强癌细胞中RDR1介导的miRNA加尾事件
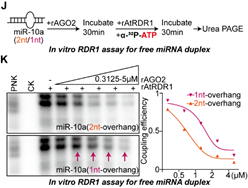
图5 RDR1更倾向于识别游离的具有1-nt悬垂的miRNA双链异构体作为底物
4、RDR1抑制多种小鼠实体瘤和白血病的进展
接下来,作者想在小鼠体内验证植物RDR1的抗肿瘤作用。首先,作者将RDR1诱导型癌症细胞系注射免疫缺陷小鼠以进行体内荷瘤实验,并且通过Dox喂水以实现RDR1的异位表达。结果表明,野生型而非突变型RDR1显著抑制了所成肿瘤的大小、体积和重量。作者还发现,在A549,H1299和PC-3细胞所成的荷瘤中,植物RDR1能够显著提高癌细胞中miRNA的表达,从而抑制了癌细胞的细胞周期。
类似的,作者还评估了RDR1在体内白血病小鼠模型中的抗肿瘤作用。与载体对照或突变的RDR1相比,野生型RDR1能够显著抑制三种白血病细胞系(Jurkat、K562和NALM6)在免疫缺陷小鼠外周血中的增殖,并最终延长异种移植小鼠的寿命。同样,RDR1可以在体内显著增加白血病细胞中的miRNA表达以抑制白血病细胞中的关键细胞周期组分,包括CDK1、CCNE2、PLK1、CDK6等,从而抑制细胞周期。
最后,通过纳米囊泡包装体外纯化的RDR1蛋白和AAV包装的RDR1,分别在体外细胞和体内实体瘤水平上实现了RDR1的直接递送和肿瘤抑制(图6)。
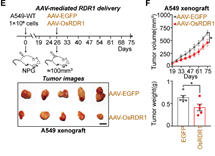
图6 AAV递送的RDR1抑制小鼠体内实体瘤生长
综上,此项研究首次揭示了在各种人类原发性肿瘤中广泛积累异常的3’末端短1-nt的 miRNA异构体,这为理解肿瘤发生过程中全局miRNA剂量的减少提供了新的见解。利用植物免疫蛋白RDR1,我们通过挽救癌细胞中的miRNA缺陷来实现广谱的抗肿瘤反应,并开发了一种新的策略来编辑和操纵miRNA,使之成为对抗癌症等人类疾病的强大武器。
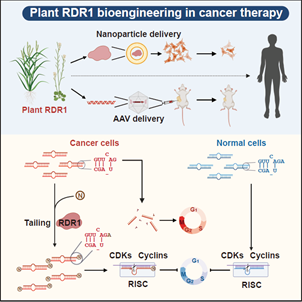
模式图表示植物 RDR1 通过挽救癌症中的 microRNA 缺陷来实现广谱的抗肿瘤反应
金沙集团wwW3354CC/北大-清华生命科学联合中心的杜鹏研究员为该论文的通讯作者。北京大学前沿交叉学科研究院博士研究生齐烨和金沙集团wwW3354CC博士研究生丁力为本文的并列第一作者。北京大学前沿交叉学科研究院博士研究生张司文参与了部分工作,北京大学博士研究生姚升泽(已毕业)和博士后翁健莉也对本文有重要贡献。北京大学李毅和吴虹教授合作参与完成了这一工作,并给予了大力支持。该项目得到了国家自然科学基金、北京大学“细胞增殖与分化”教育部重点实验室、北大-清华生命科学联合中心和北大-启东创新基金的资助。
原文链接:https://doi.org/10.1016/j.cell.2022.04.030
博士后招聘:
北京大学杜鹏实验室依托于金沙集团wwW3354CC和北大-清华生命科学联合中心,从事RNA调控,干细胞及肿瘤生物学的相关研究。主要致力于分析和鉴定未知的RNA调控通路,并研究相关RNA调控通路在胚胎干细胞的分化命运决定和早期胚胎发育中的功能。同时,我们也尝试于在动物细胞中重组植物或微生物中特异的RNA调控通路,并研究其潜在的转化医学中的应用。现诚聘博士后2-3名。详细信息请见链接:http:/homes/Index/news_cont/37/16104.html
参考文献:
1 Bartel, D.P. (2018). Metazoan MicroRNAs. Cell 173, 20-51. 10.1016/j.cell.2018.03.006.
2 Lin, S., and Gregory, R.I. (2015). MicroRNA biogenesis pathways in cancer. Nat Rev Cancer 15, 321-333. 10.1038/nrc3932.
3 Otto, T., and Sicinski, P. (2017). Cell cycle proteins as promising targets in cancer therapy. Nat Rev Cancer 17, 93-115. 10.1038/nrc.2016.138.
4 Hydbring, P., Wang, Y., Fassl, A., Li, X., Matia, V., Otto, T., Choi, Y.J., Sweeney, K.E., Suski, J.M., Yin, H., et al. (2017). Cell-Cycle-Targeting MicroRNAs as Therapeutic Tools against Refractory Cancers. Cancer Cell 31, 576-590 e578. 10.1016/j.ccell.2017.03.004.
5 Cao, M., Du, P., Wang, X., Yu, Y.Q., Qiu, Y.H., Li, W., Gal-On, A., Zhou, C., Li, Y., and Ding, S.W. (2014). Virus infection triggers widespread silencing of host genes by a distinct class of endogenous siRNAs in Arabidopsis. Proc Natl Acad Sci U S A 111, 14613-14618. 10.1073/pnas.1407131111.
6 Ma, J.-B., Ye, K., and Patel, D.J. (2004). Structural basis for overhang-specific small interfering RNA recognition by the PAZ domain. Nature 429, 318-322.
7 Curaba, J., and Chen, X. (2008). Biochemical activities of Arabidopsis RNA-dependent RNA polymerase 6. J Biol Chem 283, 3059-3066. 10.1074/jbc.M708983200.