检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
检测到您当前使用浏览器版本过于老旧,会导致无法正常浏览网站;请您使用电脑里的其他浏览器如:360、QQ、搜狗浏览器的极速模式浏览,或者使用谷歌、火狐等浏览器。
 下载Firefox
下载Firefox
2022年6月29日,中山大学丁俊军研究团队与北京大学李程研究团队在Cell Research上发表最新研究成果。该研究首次揭示了染色质结构因子CTCF除介导经典环挤压模型调控较短距离(小于2Mb)的染色质互作外,还可通过非经典相分离模型介导极长距离(大于10Mb)、跨染色质区室的染色质互作,并参与基因表达调控。

真核细胞的基因组通常长约2米,有序折叠在仅有10微米的细胞核中,形成包括染色质区室、染色质拓扑结构域(简称TAD)以及染色质环(简称Loop)等不同尺度的染色质结构 ADDIN EN.CITE ADDIN EN.CITE.DATA 1-3。不同程度的染色质结构异常会引起发育异常甚至是肿瘤的发生 ADDIN EN.CITE ADDIN EN.CITE.DATA 4-6。根据染色质状态和基因密度,染色质区室又可细分为A与B 两类。其中A 区室染色质状态相对开放,基因密度高,基因表达相对活跃;而B 区室中基因密度低,基因表达相对沉默。同类型的染色质间隔更易发生染色质互作,即AA互作或者BB互作,称为染色质区室化 ADDIN EN.CITE ADDIN EN.CITE.DATA 1。染色质区室化程度在细胞命运转变过程中常发生动态变化。经典染色质结构因子CTCF、cohesin蛋白介导的“环挤压”模型是目前领域内广泛认可的解释Loop及TAD形成的经典模型7-12,而介导区室化形成,尤其是介导基因广泛活跃转录的A间隔间的极长距离互作的形成机制,领域内仍缺乏解释。
在该项研究中,研究人员首先利用HiChIP技术,在小鼠胚胎干细胞中发现了CTCF参与A 区室之间的极长染色质互作;联合Hi-C数据,发现A区室间的互作随CTCF的敲除而减弱。由于CTCF结合位点的DNA序列方向分析显示CTCF参与的A区室间互作不符合经典的“环挤压”模型,研究团队猜测CTCF可能以一种独立于“环挤压”模型的方式介导A 区室间的互作。
在探究CTCF介导的极长距离互作的具体机制的过程中,研究团队首先发现了CTCF在细胞核内表现出相分离的特点,但体外纯化的蛋白很难形成液滴。这预示着可能存在其它因子辅助CTCF形成相分离;通过分析CTCF的互作蛋白,研究者不仅发现与CTCF直接发生蛋白间互作的RYBP具有最高比例的无序氨基酸,体内外均表现出相分离的特点,且进一步证明了CTCF的相分离依赖于RYBP;此外,通过分析RYBP敲除后的Hi-C及CTCF
HiChIP数据,研究团队发现CTCF介导的A 区室间互作也依赖于RYBP。为进一步探究CTCF的相分离在A 区室间互作形成中的作用,研究者首先通过敲除RYBP的方式破坏了CTCF的相分离以减弱A 区室间的互作;随后,在RYBP敲除细胞中融合表达CTCF与HNRNPA1 IDR以构建人工诱导CTCF相分离系统,进行Hi-C实验并进行数据分析,发现诱导CTCF相分离可显著恢复A 区室间互作;而利用1,6-hex进一步破坏造相后细胞中的相分离,Hi-C数据显示A 区室间的互作又重新减弱。从而证明了CTCF通过相分离的方式
调控A 区室间的互作。
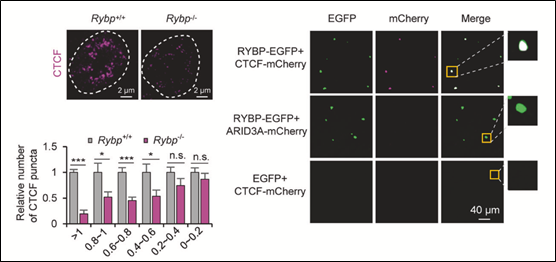
图-2. RYBP促进CTCF相分离调(摘自《Cell Research》发表论文)
研究者进一步证实了CTCF相分离可参与干细胞多能性调控。CTCF相分离倾向于在胚胎干细胞中富集,而在神经祖细胞中CTCF相分离能力则明显减弱;在小鼠胚胎干细胞中,通过敲除RYBP破坏CTCF相分离,RNA-seq数据显示大量临近A 区室间互作中心的基因表达下调,且下调的基因主要富集在细胞增殖相关的通路上;增殖实验结果表明,破坏CTCF相分离可显著降低胚胎干细胞的自我更新能力,而诱导CTCF相分离则显著恢复胚胎干细胞的自我更新能力;此外,在胚胎干细胞向神经祖细胞分化的过程中,诱导CTCF相分离则可抑制其分化。因此,CTCF相分离维持干细胞的自我更新,并抑制其向神经祖细胞分化。
研究者进一步解析了RYBP依赖的CTCF相分离与Polycomb body的关系。RYBP一直被认为是Polycomb 复合物的成分,抑制发育基因的表达 ADDIN EN.CITE ADDIN EN.CITE.DATA 13,14。而Polycomb 复合物的成分可聚集在Polycomb body中形成相分离,因此CTCF相分离本质上是否就是Polycomb body?研究者发现RYBP与CTCF在染色质上共富集的位点低富集Polycomb 复合物中的核心修饰酶RING1b,但高富集转录激活的组蛋白修饰;大部分RYBP与CTCF共聚集的puncta缺乏RING1b;干扰CTCF相分离与干扰Polycomb 复合物后的差异表达基因存在很大的差异。因此证明RYBP依赖的CTCF相分离与Polycomb body存在着明显的差异。
综上所述,该研究首次揭示了CTCF具有调控染色质区室间极长距离互作的新功能,并提出了CTCF通过RYBP依赖的相分离的方式调控染色质极长距离互作的新模型;同时揭示了操控CTCF的相分离可调控胚胎干细胞的多能性;从而在染色质区室层级上,填补了领域内染色质三维结构形成的重要理论空白。
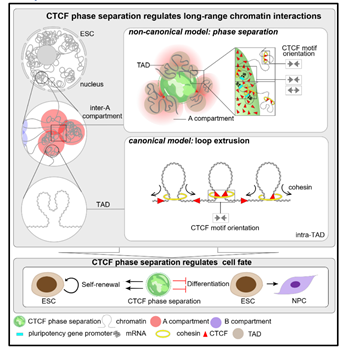
图-3. CTCF通过相分离调控染色质长距离互作的非经典模型(摘自《Cell Research》发表论文)
中山大学丁俊军教授与北京大学李程研究员是该研究的共同通讯作者,中山大学魏超博士、北京大学贾璐萌博士、以及中山大学博士生黄小娜、谭瑾为该研究成果的共同第一作者。清华大学博士生牛静完成了成像实验探针的制备,清华大学张奇伟教授、副研究员高军涛、北京大学孙育杰教授、博士生侯英萍对相关成像实验提供了重要建议和支持。
李程研究组链接:www.3d-genome.life
原文链接:https://doi.org/10.1038/s41422-022-00676-0
参考文献
1 Lieberman-Aiden, E. et al. Comprehensive mapping of long-range interactions reveals folding principles of the human genome. Science 326, 289-293, doi:10.1126/science.1181369 (2009).
2 Dixon, J. R. et al. Topological domains in mammalian genomes identified by analysis of chromatin interactions. Nature 485, 376-380, doi:10.1038/nature11082 (2012).
3 Rao, S. S. et al. A 3D map of the human genome at kilobase resolution reveals principles of chromatin looping. Cell 159, 1665-1680, doi:10.1016/j.cell.2014.11.021 (2014).
4 Weintraub, A. S. et al. YY1 Is a Structural Regulator of Enhancer-Promoter Loops. Cell 171, 1573-+, doi:10.1016/j.cell.2017.11.008 (2017).
5 Lupianez, D. G. et al. Disruptions of topological chromatin domains cause pathogenic rewiring of gene-enhancer interactions. Cell 161, 1012-1025, doi:10.1016/j.cell.2015.04.004 (2015).
6 Flavahan, W. A. et al. Insulator dysfunction and oncogene activation in IDH mutant gliomas. Nature 529, 110-+, doi:10.1038/nature16490 (2016).
7 Rao, S. S. P. et al. Cohesin Loss Eliminates All Loop Domains. Cell 171, 305-+, doi:10.1016/j.cell.2017.09.026 (2017).
8 Fudenberg, G. et al. Formation of Chromosomal Domains by Loop Extrusion. Cell Rep 15, 2038-2049, doi:10.1016/j.celrep.2016.04.085 (2016).
9 Kim, Y., Shi, Z., Zhang, H., Finkelstein, I. J. & Yu, H. Human cohesin compacts DNA by loop extrusion. Science 366, 1345-1349, doi:10.1126/science.aaz4475 (2019).
10 Davidson, I. F. et al. DNA loop extrusion by human cohesin. Science 366, 1338-1345, doi:10.1126/science.aaz3418 (2019).
11 Tang, Z. H. et al. CTCF-Mediated Human 3D Genome Architecture Reveals Chromatin Topology for Transcription. Cell 163, 1611-1627, doi:10.1016/j.cell.2015.11.024 (2015).
12 Lomvardas, S. et al. Interchromosomal interactions and olfactory receptor choice. Cell 126, 403-413, doi:10.1016/j.cell.2006.06.035 (2006).
13 Neira, J. L. et al. The Transcriptional Repressor RYBP Is a Natively Unfolded Protein Which Folds upon Binding to DNA. Biochemistry-Us 48, 1348-1360, doi:10.1021/bi801933c (2009).
14 Gao, Z. et al. PCGF homologs, CBX proteins, and RYBP define functionally distinct PRC1 family complexes. Mol Cell 45, 344-356, doi:10.1016/j.molcel.2012.01.002 (2012).